マレーシアで事業を拡大するための紹介
製薬および医療機器産業(7回シリーズ)
第2回 マレーシアのヘルスケア状況:医薬品
第2回:マレーシアのヘルスケア状況:医薬品
マレーシアには強力な製薬業界があり、政府と緊密に協力して、革新的な医療ソリューションを提供することで、国の医療システムをサポートしてきました。これは、政府による促進と開発の対象となる新しい成長分野の1つであり、マレーシア保健省の国家医薬品規制庁(NPRA)によって監視および規制されています。
製薬技術とキープレーヤー
マレーシアの医薬品は、以下のように大きく分類できます。
1. 新薬(NDP)
2. バイオロジックス
3. ジェネリック医薬品(毒物および非処方薬(OTC))
4. 健康と栄養補助食品
5. 伝統医学
6. 動物用製品
NPRAによると、2020年には合計1,425件の新製品登録申請があり、1,574件の製品(前年度からの登録を含む)が登録されました。これらの製品の内訳は下図のとおりです。その中の約54%が地元製品であり、46%が輸入製品となります。 2020年12月現在、国内で登録されている医薬品の総数は24,000を超えています。

NPRAによる2020年に登録された製品の数
ソース:NPRA 2020 Annual Report
NPR 2020 Annual Report にも報告されましたが、2020年だけで、下のグラフに示すように、271の製造業者ライセンス、443の輸入業者ライセンス、および1,111の卸売業者ライセンスライセンスが発行されました。ご覧のように、2016年から2020年にかけて毎年発行される医薬品卸売業者ラインセンスの数は製造業者ラインセンスの4倍以上であるため、国内での販売業者の確保に問題はないと言えるでしょう。
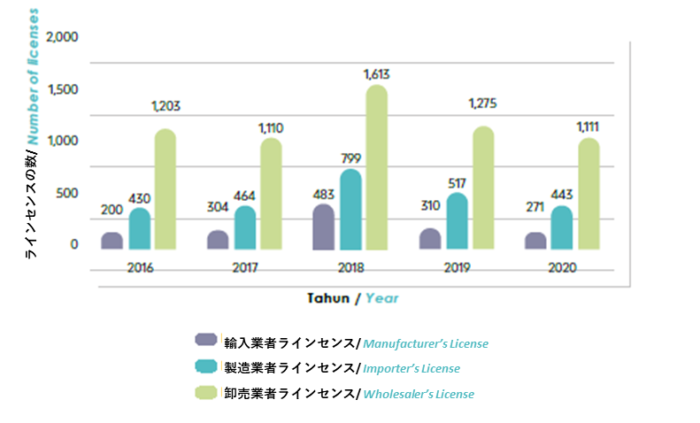
NPRAが2016年から2020年(5年間)に発行したライセンス/証明書の数
ソース:NPRA 2020 Annual Report
マレーシアの製薬業界は、地元企業及び研究ベースの多国籍企業という2つの主要なプレーヤーで構成されています。Pharmaniaga Manufacturing Berhad、Hovid Berhad、Duopharma Biotech Berhad、Kotra Pharma(M)Sdn Bhd等の地元企業は、主に伝統医薬品、ビタミン、サプリメント、市販薬(OTC)、ジェネリック医薬品に焦点を当てています。製品製造の他、地元企業は多国籍企業(MNC)の委託製造としても活動しています。
Biocon Sdn. Bhd.(インド)、Y.S.P. Industries(M)Sdn. Bhd.(台湾)、Sterling Drug(M)Sdn. Bhd.(英国のGlaxoSmithKlineの製造部門)及びXepa-Soul Pattinson(M)Sdn. Bhd.(シンガポール)等のような製造拠点を持つ外資系企業もありますが、ファイザー、シェリング・プラウ、ノバルティス、イーライリリー、アストラゼネカ等のマレーシアにある外国企業は、主に認可された輸入業者である研究ベースの多国籍企業となります。これらの企業は、強力な研究開発能力に裏打ちされた安全性、有効性、品質が証明され、国際的にテストされ受け入れられている医薬品にマレーシアが確実にアクセスできるようにする責任を持ちます。一方、これらの会社の製品は、地元の法人企業によって販売されています。
マレーシアの製薬業界は、眼科用製剤、注射剤、ソフトゼラチンカプセル、徐放性医薬品等の無菌製剤を含む、ほとんどの剤形を製造する能力を持っています。 2002年1月にマレーシアは医薬品査察協定及び医薬品査察共同スキーム(PIC / S)の26番目のメンバーとして認められました。これにより、EU、オーストラリア、カナダなどの加盟国への現地医薬品の輸出が容易になりました。
医薬品関連サービス:臨床試験および研究開発
政府は、保健省(MoH)を通じて、国の臨床研究の発展を促進するためのいくつかの戦略を導入しました。 MoHの臨床研究を担当するClinical Research Center(臨床研究センター、CRC)と、2012年にMoHによって設立された非営利企業であるClinical Research Malaysia(マレーシア国営医薬品開発業務受託機関、CRM)は、医薬品の研究開発活動の成長を促進し、より多くの資金提供等を従う研究(ISR)の機会を増やすことを目的としています。主に策定された戦略は次のようになります。
1. 多施設共同治験による臨床試験の容易さ
2. フェーズIVを超えたISR活動の拡大
3. 人材育成と私立探偵
4. 臨床試験の治療領域の拡大
これらの戦略の実施以降に、マレーシアで実施されたISRの合計は約1600(下の図に示します)であり、前年度から急激に増加しています。試験の大部分は治験薬、次に生物学的同等性研究、サプリメント/ハーブ製品、医療機器試験および新しい手順との順番となります。
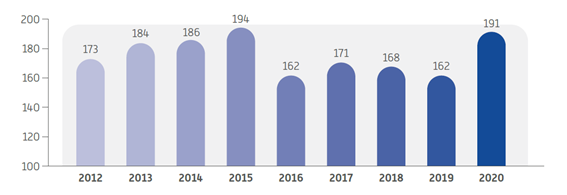
2012~2020年のマレーシアに実施されたISR案件数
ソース:CRM 2020年次報告書
1. 多施設共同治験による臨床試験の容易さ
全国で密度の異なる多民族のマレーシアでは、多施設共同治験により民族的多様性に対応する臨床試験を可能とします。全国で多数の私的および公的な臨床試験施設が利用可能であり、それぞれの施設の専門知識の多様性により、同じ臨床試験を様々な分野で実施することもできます。
2. フェーズIVを超えたISR活動の拡大
近年、CRMの様々な戦略により、国内に実施可能な臨床試験が第IV相より前の試験フェーズまで拡大されています。以下の図の通り、2020年に行われた試験の72%がフェーズIからIVの試験で構成され、残りの28%は生物学的等価性研究、登録作業、および生物医学研究が構成されました。
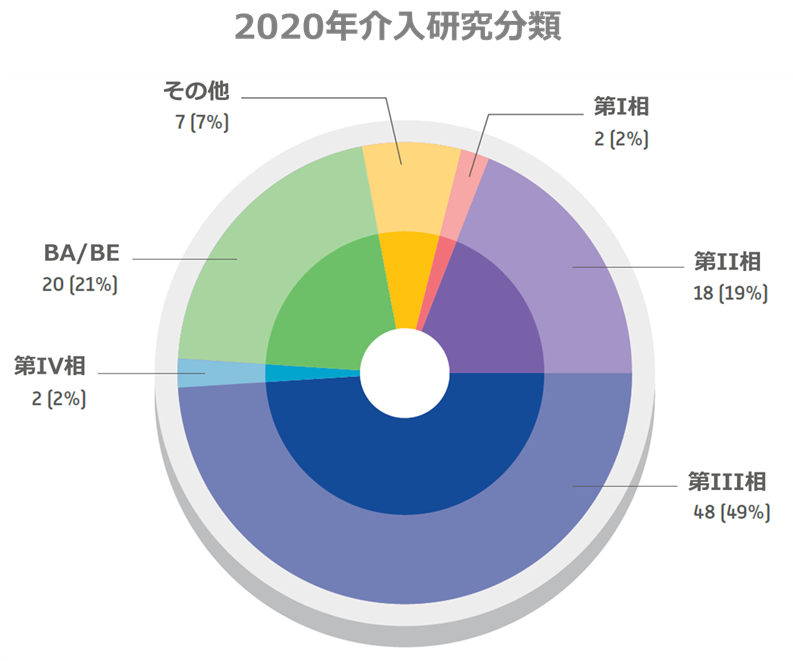
2020年介入研究分類
ソース: CRM 2020年次報告書
3. 人材育成と私立探偵
CRMは治験責任者を支援する資格のある研究コーディネーター(Study Coordinator, SC)のトレーニングを実施します。臨床研究エコシステムを改善するイニシアチブとして、SCが臨床研究に関連する研修を受け、治験実施施設に配置されます。
4. 臨床試験の治療領域の拡大
地元の臨床試験サイトの専門知識及びインフラストラクチャのレベルが大幅に向上することにより、近年のマレーシアに実施される治療領域の総数は約30になっています。幅広い治療分野にわたり、平均に試験の総数の95%は薬物関連であり、残りの4%と1%は、それぞれ医療機器と生物医学に関係していました(下の図に示します)。
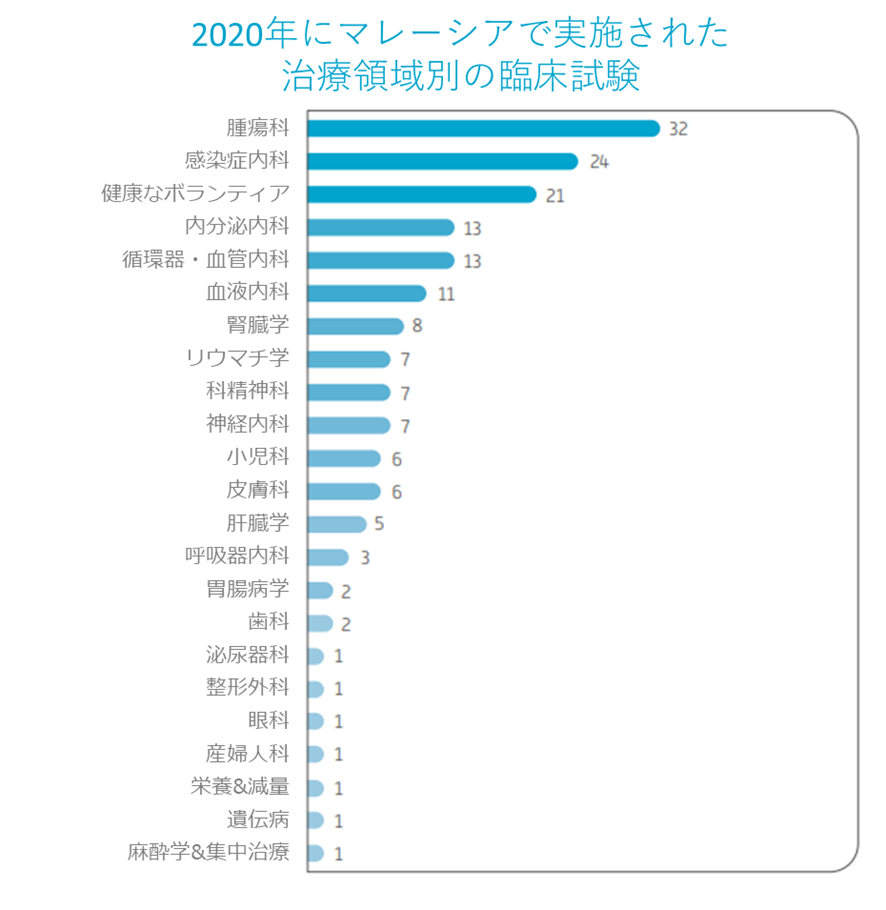
2020年にに実施された案治療領域別のISR件数
ソース:CRM 2020年次報告書
投資機会
MIDA(マレーシア投資開発庁)によると、以下は製薬業界で最も投資が見込める分野です。
1. バイオ医薬品/バイオジェネリック(バイオシミラー)
バイオシミラーの潜在的な拡大は、バイオ医薬品業界に大きな影響を与えると予想されます。バイオシミラーのバイオ医薬品業界への影響は、ジェネリック医薬品の製薬業界への影響よりも大きくはないにしても、同様であると予想されます。現在、バイオ医薬品は従来の医薬品よりもかなり高価ですが、マレーシアは利用可能なエコシステムにより、投資家により競争力のあるコストオプションを提供しています。
近年では、多数の第一世代のバイオ医薬品が成熟に近づいており、主要なバイオ医薬品企業は、これらをマレーシアのような価値の高い前置詞を提供する国に移す可能性があります。現在、マレーシアでは、国内外のプレーヤーが、モノクローナル抗体および組換えタンパク質に特化し、バイオ医薬品API、FDA/EMEA cGMP準拠サービス等の活動にすでに従事しています。さらに、バイオ医薬品の専門的な研究、開発、商品化が進行中です。政府はさらに、潜在的な投資家がバリューチェーンを上に移動することを奨励しています。
2. 受託生産サービス
現在の世界の主要な製薬会社の傾向は、製造業務を外部委託して、新薬発見のための時間と費用のかかる「遺伝子探索」研究開発方法に集中できるようにすることです。マレーシアの製薬業界は、これらの企業のジェネリックおよび特許製品を契約ベースで製造することにより、この開発を活用することができます。多くの地元企業は、利害関係者に委託製造サービスを提供することに熱心です。
3. ジェネリック医 薬品
外資系製薬企業は、特許を取得していない医薬品を製造するためにマレーシアに施設を設立することが奨励されています。
4. 漢方薬、伝統医薬
漢方薬、伝統医薬は、地元企業が製造する最も大きな種類の医薬品です。外資系製薬企業は、地元企業や研究機関と協力して新しい医薬品を製造することができます。
5. 医薬品有効成分(API)の製造
地元の医薬品の製造や輸出に使用されるAPIに対する大きな需要があります。
6. その他の高付加価値製品およびサービス
製品には、イノベーター薬、ワクチン、バイオ医薬品、吸入薬の創薬活動または新規化学物質(NCE)、および新しいデリバリーシステムが含まれます。
シーエムプラス海外情報発信HP事務局